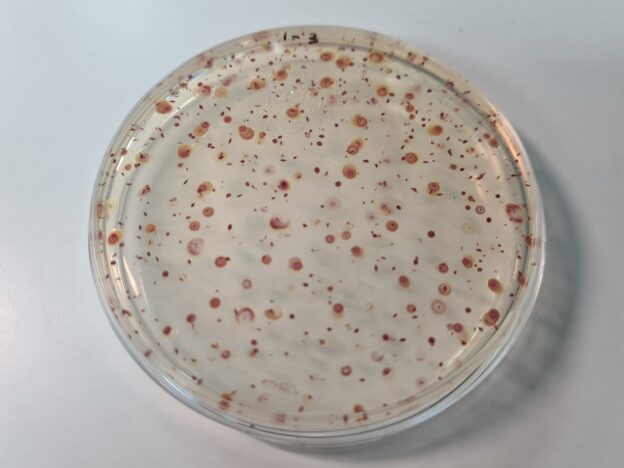
Aerobios totales, bacterias heterotrofas aerobias, recuento total. Standard Methods Agar (Plate Count Agar) y su versión cromogénica
LAS MONOGRAFÍAS DE MICROKIT. Tema 2
MONOGRAFÍA Aerobios totales
1-El microorganismo y su interrelación con el ser humano
Se denominan organismos aerobios , en contraposición a los anaerobios, a los microorganismos (bacterias y otros microorganismos detectables en medios de cultivo generales) que pueden vivir o desarrollarse en presencia del oxígeno del aire. Los que viven en presenia de niveles menores de oxígeno, se denominan microaerófilos.
El metabolismo aerobio (respiración) surgió en la evolución después de que la fotosíntesis oxigénica por parte de las cianobacterias, la forma más común de fotosíntesis, liberase a la atmósfera gran proporción de oxígeno, hasta llegar al 21% actual; el cual hasta entonces había sido muy escaso. Esta fue la primera gran extinción masiva de las 6 que ha sufrido el planeta y relegó a los anaerobios, hasta entonces los dominantes, a los fondos anóxicos de los lagos (y posterioremente al tracto digestivo de los grandes animales superiores). Inicialmente este metabolismo aeróbico representó una forma de contrarrestar la toxicidad del oxígeno (el oxígeno nos da la vida a los seres superiores, pero es quien acaba matándonos a causa de los radicales libres acumulados del envejecimiento), más que una manera de aprovecharlo. Como la oxidación de la glucosa y otras sustancias libera mucha más energía que su utilización anaerobia (por ejemplo, la fermentación), los seres aerobios pronto se convirtieron en los nuevos organismos dominantes en la Tierra. La aerobiosis es un proceso de respiración celular, en el que se usa el oxígeno para la oxidación del sustrato (por ejemplo azúcares y grasas, para obtener energía); por ejemplo, el oxígeno se usa durante la oxidación de la glucosa y se produce agua, CO2 y energía.
¿Cómo podemos definir los aerobios totales?
1-¿Los microorganismos que crean colonias en los medios generales, incubados sin atmósferas especiales?
2-¿La suma de los recuentos de todos los microorganismos buscados por el laboratorio en medios especiales, por ejemplo aerobios + levaduras + enterobacterias + Listeria + estafilococos+…?
3-¿El total de bacterias que no son anaerobias estrictas (es decir, la suma de aerobios y anaerobios facultativos), que hay en mi muestra?
Las tres son definiciones plausibles, pero en la práctica nos sorprendería ver las grandes diferencias de recuento obtenidas en estas tres definiciones, al alza o a la baja, y según cada tipo de muestra, motivadas por la población que se ha denominado “no vivificables”. Los recuentos totales en la realidad NO SON el total de microorganismos que hay en mi muestra (expresado en ufc/g), sino el total de colonias que soy capaz de obtener en mi medio general. La correlación entre ambas realidades no es lineal, como demuestran otros métodos indirectos más rápidos, pero algo hemos de ser capaces de contar y registrar, aunque la incertidumbre del recuento sea un disparate. Y por eso la definición aceptada de aerobios totales es la primera de las tres antedichas en este párrafo: porque necesitamos estandarizar el parámetro para que todos hablemos de lo mismo.
¿Cuál es el microorganismo más buscado del mundo? E.coli? Legionella pneumophila? Listeria monocytogenes? NO, son los aerobios y su recuento.
¿Para que se busca este parámetro? Es el más típico y básico indicador de higiene en los productos. Sin que eso tenga por qué ver nada con la presencia o no presencia de patógenos.
A efectos prácticos, existen diferentes poblaciones de aerobios. Lo describen bien los medios de cultivo estándar: Según PCA, en alimentos hay que incubar a 30 ºC para la detección de aerobios mesófilos, a 55 ºC para los termófilos y a 7 ºC para los psicrófilos. Según YEA, en aguas hay que incubar a 36 ± 2 ºC (para flora patógena y asociada) y duplicados a 22 ± 2 ºC (para flora saprófita). Esto sucede también en otras matrices (medicamentos, cosméticos…) donde suele incubarse a 32,5 ± 2,5 ºC y pocos laboratorios contemplan que no es lo mismo un recuento de aerobios a temperaturas cercanas al cuerpo humano (microbiota aportada en los diferentes puntos de la cadena por personas y animales de sangre caliente), que un recuento de aerobios alterativos a temperaturas similares a las del ambiente donde se almacenarán sus productos (21-25ºC en general, 4-8 ºC si son productos de nevera), aportada por el aire y las superficies. Pocas veces coinciden lo más mínimo los recuentos realizados a estos diferentes grupos de temperaturas, que proponemos denominar (dadas las temperaturas que realmente nos interesan): ambiente humano o veraniego (aprox. 30-35ºC), ambiente primaveral (aprox.20- 25ºC) y ambiente invernal o de nevera (aprox.7ºC). Cada laboratorio debería elegir cuales dos o tres temperaturas son las que pueden afectar a sus productos (la de 35ºC aprox, afecta a todos), y no cegarse con las temperaturas que digan los métodos estándar que más le atañen (ya hemos visto la gran variabilidad de temperaturas que proponen según sea el tipo de muestra). Tampoco caer en el error de creer que los aerobios totales son la suma de los hallados a las tres temperaturas, ya que aun siendo poblaciones muy diferentes, tienen miembros que se solapan, es decir, hay aerobios de ambiente veraniego e invernal que también crecen bien a temperaturas primaverales, por lo que el recuento de aerobios totales es siempre inferior al recuento de aerobios de ambiente veraniego + primaveral + invernal.
2-Los tipos de productos donde la legislación exige su búsqueda o recuento, así como otros tipos de productos donde a nuestro criterio, sería recomendable analizarlos
Medicamentos
Cosméticos
Aguas de consumo, aguas envasadas
Alimentos
Además, sea o no por orden oficial, se miran en:
Otros productos industriales donde su proliferación altera las propiedades del producto (ej: keroseno, taladrinas…)
Aires interiores
Superficies
3-Los métodos oficiales para su detección/recuento
Pharmacopea en medicamentos: TSA en medicamentos y ambientes (el mismo medio general que ha elegido la ISO 11133-2 de control de calidad de medios), y R2A en aguas (medio de excelentes resultados para los oligotróficos que resisten en las aguas ultrapurificadas).
No existe método oficial en cosméticos, aunque muchos laboratorios siguen la Normas Técnica ISO que invita al uso de TSA (y R2A en sus aguas por asimilación a Pharmacopea). Otros prefieren usar agares con inactivadores de los conservantes (Eugon, Letheen, LPT Neutralizing Agar) aunque ya hayan pasado una fase previa de inactivación en el caldo de la solución madre. Las placas preparadas de cualquiera de estos medios son utlizadas por algunos laboratorios, pero quedan fuera de rango de recuento, ya que no pueden absorber 1 mL de la solución madre (-1), a no ser que el mL se reparta en 3 placas, y por ello en quienes no lo hace en 3 placas, 1 colonia/0,1 ml equivale a 100 ufc/g, lo cual queda fuera del rango de recuento en placa (mínimo 10-15 colonias para que sea aceptable, es decir, 1000-1500 ufc/g).
En aguas de consumo y envasadas debe usarse por Directiva Europea (traducida en Real Decreto) la siembra en masa de 1 mL del agua en YEA (PCA-Water), que es un PCA especial para oligotrofos (sin glucosa). También se llama Agar Nutritivo con Triptona y Extracto de Levadura.
En alimentos y otros productos se emplea por tradición ISO el PCA (Standard Methods Agar) y en algunos lácteos el PCA-Milk. La siembra en masa de 1 ml de las diferentes diluciones decimales, invita al uso de PCA con 10,5 g/L de agar-agar (“PCA aeróbico”) en lugar de 15 g/L del mismo, para evitar la falta de crecimiento en la zona del fondo de la placa donde no llega el aire cuando la concentración del gelificante es la alta. Las placas preparadas de PCA no sirven para los recuentos oficiales por siembra en masa de producto, sólo para aire y filtración de membrana (aquí sí que deben ser de 15 g/L de agar-agar). En caldo para filtración de membrana con la técnica del cartón absorbente se denomina M-TGE.
Existe controversia sobre si recupera más el TSA o el PCA, los dos grandes medios del recuento total. En nuestra experiencia, depende de la matriz y de las cepas, ya que algunas de éstas crecen bien en TSA y no en PCA, y otras a la inversa, porque unas prefieren la sal y la soja del TSA y otras prefieren la glucosa y el extracto de levadura del PCA.
En aires y superficies, la gran desconocida Norma ISO 100.012 exige el uso del LPT Neutralizing Lilac Agar (que nosotros llamamos LPT Neutralizing Agar Purple y en USA se llama D/E Neutralizing Agar), porque hay que inactivar los residuos de desinfectantes si queremos obtener recuentos representativos de la realidad. Al parecer casi nadie hace caso a esta Norma y cada uno emplea el medio que usa para sus productos, olvidando la importancia crítica de la afirmación de la frase anterior.
4-Los métodos alternativos que mejoran la rapidez de los resultados y la robustez del análisis
Hay otros muchos medios que han demostrado obtener recuentos incluso superiores a los oficiales en diferentes matrices, por ejemplo el Agar BHI (mucho más rico que el PCA o el TSA para cualquier matriz), el PCA carbón para superficies, el Total Marine Agar para productos del mar, el Agar Sangre para muestras clínicas, el HPC-Heterotrophic Plate Count Agar en aguas, el MDA-Microkit Diferencial Agar en superficies y aires, las diversas versiones de Nutrient Agar, el OSA-Orange Serum Agar en alimentos de pH ácido… El R2A es oficial en aguas farmacéuticas ultrapurificadas, pero funciona de forma mediocre en otras aguas, a pesar de que países como Brasil lo han adoptado para el recuento total en aguas de consumo humano. Y funciona muy mal en aires y superficies, por ejemplo.
El descubrimiento en la ultima década del siglo pasado de los agares cromogénicos, permite no sólo una detección mucho más fiable de patógenos (enzimática, en vez de la bioquímica que es propia de los medios de cultivo convencionales), sino que además, en casos como nuestros famosos PCA-cromogénico (o PCA-Milk cromogénico, o YEA-cromogénico, o Maxim Cromokit Agar…), permite una detección más evidente al ojo humano en los recuentos de aerobios, al crecer las colonias con un color rojo opaco de contraste contra el medio de cultivo y ante los artefactos que no son colonias (partículas de muestra, burbujas…). Una actualización (con cromógeno termoestable) al siglo XXI del clásico TTC termolábil, que había que añadir al PCA cuando ya se había enfriado a 45ºC. El PCA cromogénico de MICROKIT respeta los 10,5 g/L de agar-agar en vez de 15 g/L, para que la siembra en masa obtenga mayores resultados por mejor penetración del aire hasta el fondo de la placa.
Si a ello sumamos el gran invento de la placa deshidratada (en nuestro caso, Dry-Plates), nos ahorraremos el enorme retraso de tiempo que supone autoclavar-fundir-enfriar medios, homogeneizar placas, esperar que solidifiquen… Y nos ahorraremos además el gravísimo punto crítico de la temperatura de adición del medio fundido a la muestra, que destruye grandes proporciones de aerobios presentes en la muestra, como llevamos décadas observando en intercomparación, incluso cuando se hace estrictamente a 45ºC. Disponemos de Dry-Plates de recuento de aerobios de todos los medios mencionados para los diferentes sectores (TSA para medicamentos, TSA cromogénico para cosméticos, YEA cromogénico para aguas, PCA cromogénico para alimentos y otros productos).
Por otra parte, los protocolos de análisis microbiológicos de medicamentos, cosméticos y aguas tienen en cuenta que la muestra contiene o puede contener inhibidores (añadidos o no deliberadamente a la muestra como los conservantes, el Cloro…). Pero no es así en los protocolos oficiales de alimentos, que “olvidan” sistemáticamente este hecho. Cada vez hay más laboratorios de alimentos que, por vivirlo en la intercomparación, cambian del diluyente estándar (Buffered Peptone Water, TSB, Ringer, solución salina…) al Buffered Peptone Neutralizing Water (patente MICROKIT) en todos los parámetros que analizan, y se dan cuenta del gran error que supone que nadie les haya dicho que las especias y condimentos, la sal, el azúcar, las hierbas aromáticas (labiadas y compuestas), el ajo, el pimiento, las crucíferas, las umbelíferas… más que saborizantes, son realmente conservantes descubiertos desde la prehistoria del hombre para conservar alimentos, cada uno más o menos adecuado para los distintos microorganismos. Y que a veces es necesario hacer los análisis desde la dilución (-2) porque el producto es tan inhibitorio que en la (-1) no se detecta nada, como todo el mundo conoce en cosmética como “excesivo poder inhibitorio intrínseco de la muestra”.
Tras usar Buffered Peptone Neutralizing Water en alimentos o LPT Neutralizing Broth en cosméticos, lo ideal es mantener la inactivación de conservantes, usando en el recuento de aerobios el LPT Neutralizing Agar (sea con o sin púrpura, aunque ésta alerta, por viraje del medio a amarillo, mucho antes de que se manifiesten las colonias).
No son necesarias pruebas de confirmación en aerobios, ya que todas las colonias que crecen en cualquiera de los medios mencionados, se consideran aerobios si se han cultivado en aerobiosis (no anaerobios). Muchas veces crecen levaduras y mohos en estos medios de aerobios; dado que no se pueden distinguir a simple vista las colonias de bacterias de las de levaduras (a pesar de algunas leyendas urbanas que dicen lo contrario), se consideran éstas también como aerobios. Sucede algo parecido a quienes buscan flora acidoláctica (ej: Lactobacilos), ya que incluso en los medios especiales para ellos (ej: MRS) los aerobios interfieren con las diana por tener colonias muy similares (aunque los Lactobacilos tienen colonias blancas y opacas, no traslucidas y/o de otros colores como los aerobios).
Lo que creemos que sería necesario en este caso, es verificar la productividad del medio, es decir, qué porcentaje de aerobios reales es capaz de recuperar cada medio; a causa del concepto de no vivificables, no cultivables, subletales, letárgicos o como queramos llamarlos. Esto debería hacerse (para muestras idénticas) con todos los medios mencionados para cada tipo de matriz, y así emplear después de rutina el que más altos (reales) resultados proporcione en cada caso. Sorprenderán las enormes diferencias de hasta 3 órdenes de magnitud entre unos medios y otros en función de la matriz analizada, a quienes todavía son pioneros, apuesten por mejorar las cosas preconcebidas y hagan este experimento revelador con sus productos concretos.
Hay por inercia multitud de laboratorios haciendo las cosas como les han enseñado o como dicen los métodos oficiales, sin plantearse que por ejemplo, un producto de pH 4, pasado por una agua peptonada tamponada a pH 7, no ha sido contemplado en esos métodos oficiales, y probablemente haya perdido su flora natural (o su capacidad para manifestarse) mientras la analiza: doble error, no se manifiesta en el medio de cultivo, pero sí en el producto. Lo mismo que el ejemplo de productos hiperosmóticos a los que se hace la microbiología a la dilución (-1) en vez de hacérsela a la (-2) para permitirles que se manifiesten. Sin duda, queda mucho por escribir en microbiología de alimentos.
También en microbiología de cosméticos, donde sigue habiendo numerosos laboratorios que toman como única referencia el recuento de aerobios y el de hongos en 1 g (en realidad en 0,1 g, al partir obligadamente de la dilución (-1)), y deciden unilateralmente que si sale “0”, ya no hay patógenos. Gravísimo error, cuando los patógenos necesitan enriquecimiento revitalizador para manifestarse y no aparecen por arte de magia en 0,01 g de muestra sembrada en superficie (0,1 mL de la dilución (-1)) en una placa de TSA (a no ser que estén a concentraciones masivas).
5-Cómo vemos el futuro en la detección de este grupo
Como hemos esbozado antes, defendemos que cada laboratorio debería tener la libertad de elegir el medio de cultivo para recuento de aerobios que mejor le demuestre que los enumera en sus propios productos. El estándar debe ser el recuento más alto obtenido, porque será el más cercano a la realidad para que podamos convertir con confianza, tras aplicar el factor de dilución empleado, las colonias/placa en ufcs/g.
Si desea esta monografía completa en pdf, con las fotos que aqui no aparecen, solicítela en consultastecnicas@microkit.es
https://www.microkit.es/fichas/PLATE-COUNT-AGAR-polvo-aerobico-STANDARD-METHODS.pdf
https://www.microkit.es/fichas/PLATE-COUNT-AGAR-CROMOGENICO.pdf